RECURSOS
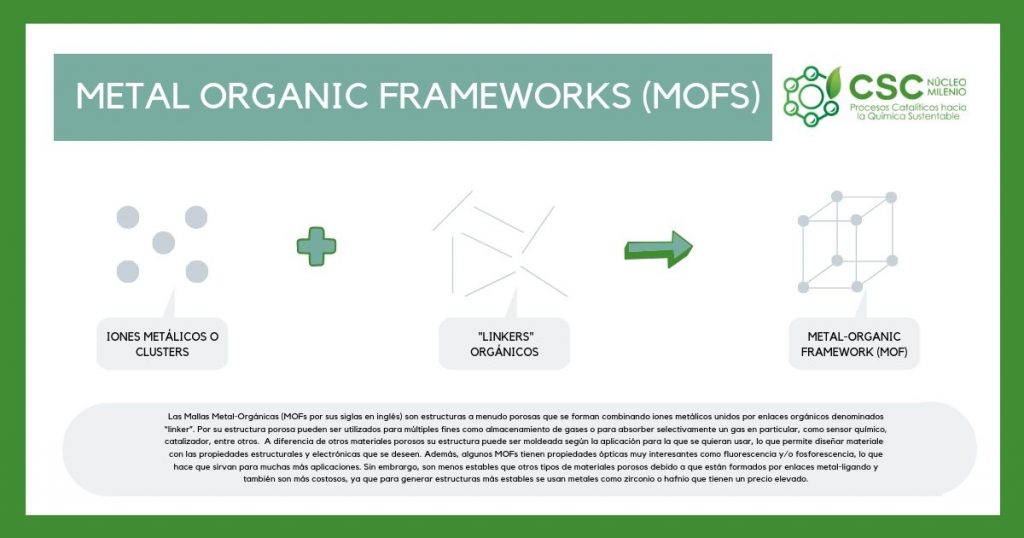
MOFS, la revolución de las moléculas
Las Mallas Metal-Orgánicas, más conocidas como MOFs por su sigla en inglés, son moléculas revolucionarias hechas a la medida de múltiples aplicaciones. Desde mediados de la década de los 90´s han capturado la atención de la comunidad científica mundial, luego que el académico de la Universidad de California en Berkeley, Omar Yaghi, reveló su potencial para la captura y almacenamiento de dióxido de carbono (CO2), la obtención de combustibles limpios y para capturar las moléculas de agua en el aire y generar a partir de ellas agua potable, entre otras aplicaciones.
En términos científicos los MOFs son compuestos cristalinos ordenados constituidos por centros metálicos (en principio puede ser cualquier elemento que tenga carácter metálico de la tabla periódica) conectados por fragmentos orgánicos, denominados linker. La estructura ordenada obtenida por esta combinación genera una malla porosa donde se pueden almacenar gases o drogas (para su posterior liberación). Otras aplicaciones posibles es usar los MOFs como tamiz molecular (para producir la separación por tamaño de diferentes moléculas), como sensores químicos, como catalizadores, entre muchas otras.
Con respecto al resto de los materiales porosos, los MOFs tienen la ventaja que su estructura puede ser moldeada según la aplicación en la cual el material quiera ser utilizado. Así, de forma similar a la que se configuran las piezas de un Lego, los científicos son capaces de crear MOFs cómo ellos deseen, mediante la modificación del linker orgánico y/o del centro metálico utilizado.
En el Núcleo Milenio en Procesos Catalíticos hacia la Química Sustentable utilizamos los MOFs para generar productos derivados de la biomasa con alto valor agregado. Así, por ejemplo, a partir de benzaldehído, un compuesto químico utilizado comúnmente como saborizante de alimentos, estamos generando benzaldehído acetal, cuyo valor puede llegar a ser 3 veces superior al producto original. Además, mediante la utilización, tanto de química computacional como de manera experimental, nos encontramos estudiando el mecanismo de reacción sobre el MOF, con la finalidad de realizarle modificaciones e incrementar la actividad catalítica del material.
Los MOFs también pueden ser usados en catálisis heterogénea, ya que presentan las ventajas de este tipo de catalizadores, es decir, pueden ser separados del medio donde se realizó la reacción química y reutilizados nuevamente en un nuevo proceso catalítico. Por otra parte, algunos MOFs presentan propiedades ópticas muy interesantes como fluorescencia y/o fosforescencia, lo cual amplía aún más la gama de aplicaciones de este tipo de materiales.
En cuanto a sus desventajas, los MOFs presentan una menor estabilidad en comparación con otros materiales porosos debido a la presencia de enlaces metal-ligando. Además, poseen un alto costo, debido a que el valor de los centros metálicos que generan estructuras más estables tales como zirconio o hafnio, es elevado en comparación al resto de los posibles metales de la tabla periódica.

La biomasa, promesa de un futuro con cero emisiones
La biomasa es materia orgánica que se origina como resultado de la fotosíntesis. Existe biomasa que proviene de los residuos forestales, los desechos industriales o domiciliarios, los residuos agrícolas, y de los desechos de los animales. Su uso sirve para producir energía o materias primas para miles de productos que hoy se fabrican usando petróleo (fibra óptica, envases, prótesis, suelas de zapatos, etc).
El uso de la biomasa tiene múltiples beneficios para el medio ambiente si se compara con el de los combustibles fósiles (carbón, petróleo y gas natural). Los árboles y plantas a medida que crecen absorben CO2 del aire y cuando mueren, parte del carbono del CO2 queda atrapado en la vegetación. A lo largo de miles de años las capas de vegetación son comprimidas y transformadas ya sea en carbón, petróleo o gas natural que son combustibles fósiles. El carbono que fue sacado de la atmósfera es en efecto “secuestrado” en las profundidades de la tierra.
Luego, cuando por ejemplo el carbón es extraído de la tierra y combustionado para generar energía, se libera CO2, el cual es el principal gas responsable de efecto invernadero y por lo tanto del calentamiento global. Este es el ciclo biogeoquímico del carbono, el cual es insostenible, ya que los combustibles fósiles son recursos no renovables, es decir limitados, y su uso aumenta los niveles de CO2 en la atmósfera.
En el caso de la biomasa, el carbono que la forma no está secuestrado en las profundidades de la tierra, sino que es parte del ciclo biológico del carbono, está atrapado dentro de árboles y plantas. Al utilizarse esta biomasa para la producción de energía u otros productos ocurre un circulo virtuoso, ya que la biomasa crece por fotosíntesis consumiendo el CO2 atmosférico, luego aquella que es utilizada se quema o se trata generando emisiones de CO2 que son capturadas por nuevas plantas y árboles generando más biomasa. Este ciclo es sostenible ya que la biomasa es un recurso renovable y carbono neutral, es decir, el CO2 que se genera al final de su uso, proviene de la atmósfera, por lo tanto, no hay aporte neto de CO2, ni se incrementa el efecto invernadero.
Sin embargo, el uso sustentable de la biomasa depende del proceso en el que se utilice y del uso que se le dé. Por ejemplo, usar la biomasa como leña para calefacción doméstica, no es sustentable actualmente en Chile, debido a que la alta humedad de la leña genera emisiones de material particulado durante la combustión que son altamente contaminantes para el aire. Si esta misma biomasa se utiliza para producir combustibles de mejor calidad, tales como pellet o briquetas, sí se trataría de un producto sustentable.

¿Es posible un futuro sin petróleo?
El petróleo es un líquido negro viscoso que consta de una compleja mezcla de compuestos orgánicos, principalmente hidrocarburos. Se encuentra dentro de la clasificación de combustible fósil y es posible encontrarlo en grandes cantidades en yacimientos subterráneos que se formaron millones de años atrás, luego de un proceso de intenso calor y presión a la que fueron sometidos organismos enterrados bajo rocas sedimentarias en el fondo del océano.
Desde su descubrimiento, el petróleo se ha vuelto indispensable en la vida de las personas en todo el mundo. Su uso más conocido es en combustibles, parafinas, asfaltos y lubricantes. Pero además de ello, el petróleo es fundamental para la confección de fibras textiles, plásticos, acrílicos, pinturas, detergentes, insecticidas, fármacos, entre otros.
El petróleo es un recurso no renovable, lo que significa que en algún momento se agotarán sus reservas. Además, su producción conlleva importantes desafíos para el medio ambiente, ya que la reacción de combustión producida por los combustibles obtenidos a partir del petróleo, generan dióxido de carbono (CO2) el que se acumula en la atmósfera aumentando la concentración de gases de efecto invernadero y por lo tanto la temperatura promedio en la tierra, lo que a su vez acelera el cambio climático.
Se han buscado diversas alternativas para reemplazar este combustible fósil. Entre todas las energías renovables, se ha encontrado que solo a partir de biomasa vegetal, es posible obtener los mismos compuestos líquidos que los derivados del petróleo. Por lo tanto, a partir de adecuados tratamientos de biomasa vegetal, principalmente térmicos y catalíticos, es posible reemplazar a los derivados del petróleo.
La biomasa vegetal presenta una ventaja muy importante respecto a los derivados del petróleo; es una fuente renovable y carbono neutral, ya que la combustión de los combustibles obtenidos genera CO2 que las plantas pueden absorber por medio de la fotosíntesis, lo cual evita un aumento de su acumulación en la atmósfera. Además, su uso promueve una valorización de residuos incrementando su valor agregado. Entre los desafíos que presenta el uso de la biomasa se encuentra la elevada demanda actual de los derivados del petróleo, la cual es muy difícil reemplazar completamente a partir de biomasa.

¿Qué es una reacción química?
Una reacción química es un proceso en el que una sustancia cambia convirtiéndose en otra nueva, debido a que se generan y/o rompen los enlaces entre los átomos que la forman. Así por ejemplo, en los convertidores catalíticos de los automóviles se descompone el dióxido de nitrógeno contaminante (NO2) para generar dinitrógeno (N2) y dioxígeno (O2) que no contaminan.
Algunos indicadores de que está sucediendo una reacción química que pueden observarse a simple vista son la generación de luz, calor y los cambios de color en las sustancias, tal como ocurre durante la combustión de la madera.
Diariamente experimentamos muchos ejemplos de cambios químicos sin estar concientes de ello. Las reacciones químicas están presentes en nuestras vidas de muchas maneras, en el funcionamiento de los automóviles, la coción de los alimentos, la disolución del jabón, la oxidación de los metales, etc.

¿Para qué sirven las reacciones químicas?
Las reacciones químicas se utilizan para diferentes fines: generar calor, limpiar, hacer funcionar la batería de un celular y producir una amplia gama de productos fundamentales para la vida diaria desde cemento hasta medicinas.
La cocción de los alimentos es uno de los ejemplos más comunes de reacciones químicas que utilizamos a diario. Las reacciones que ocurren rompen las sustancias que componen los alimentos haciéndolos más blandos y facilitando la digestión al ingerirlos.
Los fuegos artificiales utilizados en celebraciones son producidos por reacciones químicas de combustión. Según las sustancias que los compongan se producen los diferentes colores que tanto llaman nuestra atención.
Los contaminantes que producen los autos son descompuestos por reacciones químicas que ocurren en los convertidores catalíticos en el escape del motor. Así se disminuye el impacto nocivo de las emisiones del transporte automotor.

Tipos de reacciones químicas
Existen disímiles tipos de reacciones químicas. Para facilitar su estudio se agrupan según la su naturaleza en: reacciones de formación, reacciones de descomposición, reacciones de sustitución, reacciones de oxidación-reducción y reacciones de ácido-base.
Reacciones de Descomposición
A partir de una sustancia compuesta se originan dos o más sustancias como ocurre por ejemplo con el bicarbonato de sodio usado para hornear que se descompone en tres sustancias si se calienta lo suficiente.
Reacciones de Sustitución
Tiene lugar una recombinación o intercambio de alguno de los átomos existentes. Por ejemplo, el hierro en contacto con sulfato de cobre produce cobre y sulfato de hierro.
Reacciones de Formación
Dos sustancias dan lugar a la formación de un compuesto. Así se forma el dióxido de carbono desde las brasas.
Reacciones Redox
Una sustancia se oxida al perder electrones y otra se reduce ganándolos. Esto ocurre con los metales al oxidarse.
Reacciones Ácido – Base
Un ácido y una base se neutralizan dando lugar a una sal como la de nuestra cocina.

¿Qué es una ecuación química?
Las ecuaciones químicas surgen cuando en el estudio de las reacciones químicas los científicos desarrollaron una forma común de representarlas, permitiendo la comunicación entre ellos.
Una ecuación química es la representación simbólica de una reacción química. Esto permite que importantes reacciones, como la fotosíntesis que realizan las plantas, puedan representarse con símbolos para ser estudiadas.
Las sustancias iniciales se denominan reactivos y las que se generan, productos. Los reactivos se escriben a la izquierda y los productos a la derecha de la flecha que indica que ocurre el cambio.
Las ecuaciones químicas tienen que estar estequiométricamente balanceadas, es decir, debe haber el mismo número de átomos de cada elemento a ambos lados de la flecha, tanto en los reactivos como los productos. De ser necesario se deben colocar coeficientes delante de las sustancias.

¿Qué es una reacción de hidrogenación?
La hidrogenación es una reacción química que implica la adición de dihidrógeno (H2) a otra sustancia, generalmente orgánica. La más típica implica la adición del H2 a un doble enlace carbono-carbono (C=C).
Esta reacción permite modificar la composición de grasas y aceites, disminuir las insaturaciones que contienen para hacerlos apropiados para diferentes usos. Así se puede modificar un mismo aceite para producir alimentos, jabones o cosméticos si se hidrogena en mayor o menor grado.
Requiere altas presiones y/o temperaturas además de la presencia de un catalizador para que ocurra. Los catalizadores (Cat) más utilizados son a base de níquel (Ni), cobre (Cu) o platino (Pt), entre otros. Por esta razón la reacción es heterogénea, porque ocurre en varias fases: H2 gaseoso, catalizador sólido y en ocasiones la sustancia para hidrogenar es líquida como los aceites.
La hidrogenación de CO2 se utiliza como alternativa para producir combustibles verdes. También tiene aplicaciones en la mejora de las propiedades del bio-oil obtenido en la pirólisis de biomasa, ayudando a encontrar alternativas sustentables al petróleo.

¿Qué es una reacción de hidrólisis?
La hidrólisis es una reacción química que implica la ruptura de un enlace por acción del agua (H2O). Su nombre proviene de los vocablos griegos hydro (“agua”) y lýsis (“ruptura”).
Un ejemplo común de nuestra vida diaria es la hidrólisis de la sacarosa que no es más que el azúcar común de mesa. Está compuesta por una molécula de glucosa y una de fructosa. En contacto con agua y un ácido se descompone en estas dos sustancias que son azúcares más pequeños.
Esta reacción tiene aplicaciones en diferentes industrias. Una de las más antiguas y útiles es la saponificación que consiste en la hidrólisis de ácidos grasos con una sustancia con propiedades básicas fuertes como el hidróxido de sodio (NaOH). El resultado es el jabón que usamos a diario.
Las investigaciones actuales sobre biocombustibles obtenidos de biomasa buscan mejorar su calidad utilizando la hidrólisis como herramienta para lograrlo.

Reacción de oxidación parcial
Una reacción de oxidación parcial (POx) como su nombre lo indica es una reacción controlada de oxidación de manera de obtener un producto intermediario que es generalmente de mayor interés que el producto de oxidación completo.
Un ejemplo muy común es una reacción de combustión controlada con un déficit de oxígeno resultando en la formación de gas de síntesis (SynGas) compuesto por monóxido de carbono e hidrógeno (CO + H2). Esa mezcla de gas es de alto interés, ya que permite crear gasolina mediante el proceso de Fisher-Tropsh; hidrógeno usando el proceso de gas a agua, o metanol que es una molécula importante a la hora de producir combustible para la aviación.
Tradicionalmente se usa gas para producir el SynGas, pero recientes desarrollos utilizan las POx como método alternativo para producir carburantes renovables a partir de derivados de la biomasa.

Producción de H2 verde
Existen distintas formas de producir hidrógeno verde, una es mediante procesos químicos y la otra a través del rompimiento de la molécula de agua por electroquímica.
Dentro de los procesos químicos se pueden destacar dos tipos de reacciones, la reacción de gas al agua y la de reformado con vapor del metano. Ambos procesos requieren agua y sirven para generar dióxido de carbono (CO2) que se considera neutral en carbón, ya que es el resultado de procesos donde se usa biomasa como materia inicial, la cual necesita captar CO2 de la atmósfera para su crecimiento.
En el caso de la producción de hidrógeno verde por electroquímica, se rompe la molécula de agua en H2 y O2 gracias al uso de electricidad. Para que ese H2 se considere verde, la electricidad tiene que ser obtenida de fuentes renovables, usando por ejemplo paneles solares o eolias.

¿Qué es un catalizador?
Los catalizadores son componentes capaces de acelerar una reacción y están presentes en casi todos los procesos industriales, desde refinerías hasta la fabricación de medicamentos. Al permitir acelerar una reacción ofrecen un camino alternativo de reacción menos cansador y ayudan a reducir los costos de fabricación.
También se pueden usar para reducir contaminantes como ocurre con los tubos de escape de los autos que contienen catalizadores que permiten transformar gases peligrosos en gases menos contaminantes.
Un ejemplo ilustrativo de cómo funcionan los catalizadores en una reacción es imaginar que quieres trasladarte de un pueblo a otro separados por una montaña. Para llegar al otro lado tendrás que escalar esa montaña, lo que supone un gasto energético alto. En ese caso el catalizador ofrece un camino alternativo, supongamos poniendo una ciclovía que rodee la montaña. La bicicleta sería el catalizador, permitiéndote ir más rápido. El catalizador no se ve modificado por la reacción y se puede volver a usar nuevamente. Eso si, el catalizador es propio a una reacción por lo tanto, si lo que quieres es atravesar un lago por ejemplo, necesitarás otro catalizador.
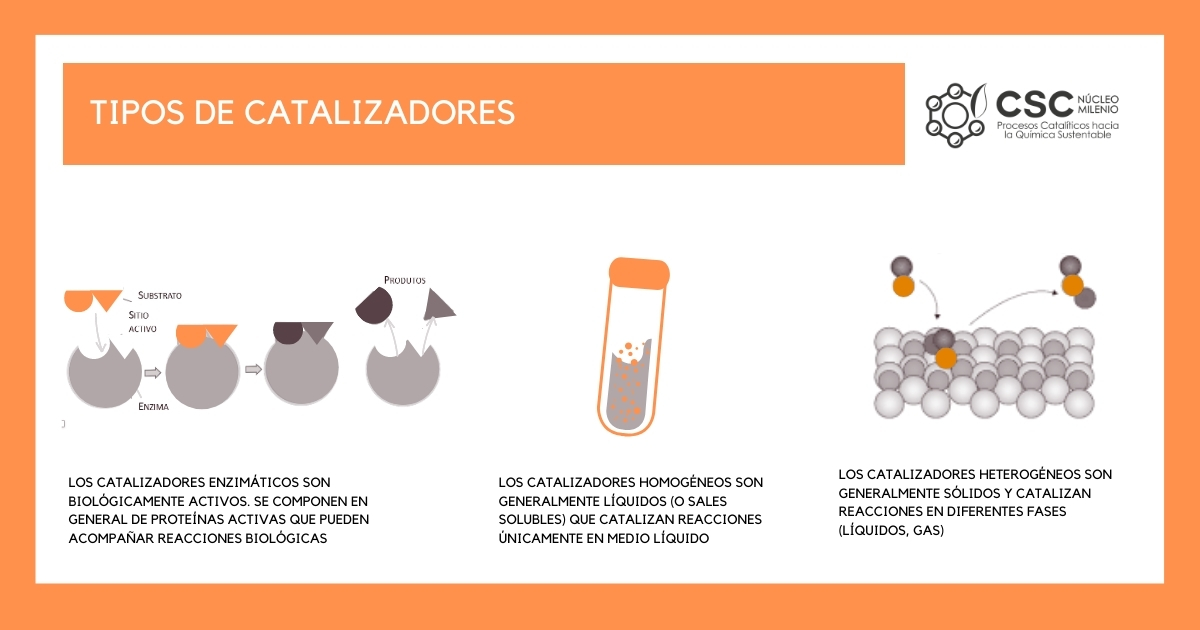
¿Qué tipos de catalizadores existen?
Existen tres tipos de catalizadores, los enzimáticos, homogéneos y heterogéneos.
Los catalizadores enzimáticos son biológicamente activos. Se componen en general de proteínas activas que pueden acompañar reacciones biológicas. Todos tenemos en nuestro cuerpo enzimas que nos ayudan en nuestro día a día, por ejemplo las enzimas amilasas están presentes en nuestro tubo digestivo y son capaces de cortar el almidón que comemos en trozos más pequeños, permitiendo que nuestro cuerpo absorba los nutrientes que aportamos. La catálisis enzimática se ocupa principalmente en industrias agro-alimenticias.
Los catalizadores homogéneos son moléculas que se encuentran en la misma fase donde ocurre la reacción. Pueden ser líquidos miscibles con el medio o sales solubles, como por ejemplo la sal que se disuelve en el agua. La principal desventaja de estos catalizadores es que son difíciles de recuperar al final de una reacción, ya que se encuentran en el mismo medio.
Los catalizadores heterogéneos son en su gran mayoría sólidos que pueden catalizar reacciones en fase líquida o gas. Son los más utilizados en la industria, ya que son fáciles de recuperar al final de una reacción.

¿Cómo funcionan los catalizadores heterogéneos?
El catalizador heterogéneo se encuentra en una fase distinta que la que se encuentran los reactivos, debido a que es un material sólido y los reactivos pueden ser un gas ó liquido.
En general un catalizador tiene como función aumentar la velocidad de una reacción, a través de la disminución de la energía de activación de una reacción, que en términos simples es una barrera que impide que los reactantes se transformen en productos.
En un catalizador heterogéneo, la reacción química es llevada a cabo en la superficie del sólido. El proceso por el cual un reactivo determinado es transformado en un producto en presencia de un catalizador heterogéneo consta de 7 etapas, pero éstas pueden ser resumidas en 3 etapas fundamentales que dependen completamente de la reactividad superficial del catalizador:
Etapa 1: adsorción de el/los reactante(s) sobre la superficie del catalizador heterogéneo. Esto hace que los enlaces se debiliten y puedan romperse más fácilmente. Además este proceso ayuda a que los reactivos se puedan encontrar en la superficie y puedan reaccionar entre si en la etapa posterior.
Etapa 2: Reacción de los reactantes en la superficie del catalizador sólido.
Etapa 3: Desorción de los nuevos productos formados desde la superficie del catalizador heterogéneo.
Un catalizador heterogéneo es más común en la industria, ya que es fácil de separar de los productos y así volver a reutilizarlo.

¿Cómo se diseña un catalizador heterogéneo?
La preparación y diseño de un catalizador heterogéneo ha sido considerada por muchos años como un “arte”, debido que para lograr ciertas propiedades deseadas y su posterior reproducibilidad se necesita la ejecución prolija y minuciosa de una serie de etapas consecutivas.
Los catalizadores heterogéneos pueden ser másicos ó soportados. En el caso de los catalizadores soportados estos pueden ser óxido-soporte ó metal-soporte. Actualmente existen diversos métodos de preparación de catalizadores heterogéneos y en los últimos años los estudios se han extendido a la preparación de catalizadores heterogéneos a escala nanométrica.
Dentro de los métodos convencionales de preparación más utilizados, por ejemplo de un catalizador metal-soporte, se encuentran el proceso de precipitación, proceso de impregnación por exceso de solvente y el proceso de impregnación incipiente. En general, un proceso de impregnación se realiza en 4 etapas:
Paso 1: Preparación de la sal precursora del metal. Se suelen utilizar sales precursoras que sean fáciles de disolver en agua, tales como nitratos y sulfatos.
Paso 2: Llenado de los poros del soporte con la solución de la sal del metal para obtener un material sólido saturado. Esta etapa consiste en poner en contacto el soporte con la solución impregnante por un cierto período de tiempo.
Paso 3: Secado para cristalizar la sal en la superficie de los poros y remover el líquido que permanece en el interior de los poros.
Paso 4: Activación del catalizador. Se realiza una etapa de calcinación para convertir la sal precursora (nitrato) en óxido. Una posterior reducción permite transformar las especies de óxido a estado metálico. Esto dependerá del catalizador que se desee producir (óxido-soporte ó metal-soporte).
Es importante destacar que la comprensión de algunos de los efectos producidos durante el proceso de preparación, tales como el lavado, secado, calcinación, etc., tendrán un efecto directo sobre la actividad catalítica de los catalizadores.

¿Cómo funciona el convertidor catalítico?
Un catalizador es una sustancia que no se consume durante una reacción química, pero si tiene la capacidad de aumentar la velocidad de transformación de reactantes en productos de dicha reacción.
Los automóviles con motor de combustión, utilizan catalizadores para tratar los gases de escape. Los catalizadores más comunes son a base de metales nobles como el paladio, el platino y el rodio. Gracias al catalizador, las sustancias contaminantes que ingresan se transforman en sustancias inocuas.
Los Hidrocarburos sin quemar (HC), se oxidan en presencia del paladio para formar CO2 y agua. El Monóxido de carbono (CO) se oxida en presencia del platino para formar CO2.
Los Óxidos de nitrógeno (NOx) se reducen en presencia de rodio separando el nitrógeno y el oxígeno para formar N2 y CO2.
Con respecto a los gases CO y CO2 es importante identificar sus diferencias: el CO es un gas tóxico que puede ser letal, ya que sustituye al oxígeno que se encuentra en la sangre, mientras que el CO2, si bien contribuye al efecto invernadero y su acumulación en la atmósfera causa serios problemas medio ambientales, no es tóxico para el ser humano.
El dispositivo encargado de reducir estas sustancias contaminantes se denomina convertidor catalítico, pudiendo ser de dos o tres vías, sirviendo cada una de las vías para convertir una sustancia diferente. Los de tres vías, además de tratar los HC y CO, tratan los Nox.

Hidrogenación catalítica de dobles enlaces
Los catalizadores más utilizados para la hidrogenación de dobles enlaces son los catalizadores metálicos como platino (Pt), paladio (Pd) ó níquel (Ni). La adición de hidrógeno (H2) al doble enlace de un alqueno por ejemplo, permite formar un alcano.
La hidrogenación catalítica es una reacción de reducción debido a que en el producto final se aumenta la cantidad de enlaces C-H. En ausencia del catalizador la barrera de energía de reacción es enorme porque el enlace H-H es muy fuerte. De acuerdo con lo anterior, el catalizador metálico disminuye la energía de activación en la hidrogenación catalítica. Los metales mencionados anteriormente se suelen depositar en la superficie de carbón activado el cual actúa como soporte de las partículas metálicas.
La principal función del catalizador es la activación de la molécula de hidrógeno, lo cual se logra enlazando los átomos de hidrógeno a la superficie metálica del catalizador. Sin el metal, la ruptura del enlace fuerte H-H no se lleva a cabo.
Luego, se transfiere el primer átomo de hidrógeno adsorbido y el alqueno se enlaza de forma débil con la superficie del metal. Todas las rupturas y formación de nuevos enlaces ocurren en la superficie del catalizador.
Posteriormente, se transfiere el segundo átomo de hidrógeno, completando la hidrogenación.
Finalmente, una vez formado el alcano (o molécula saturada) esta es liberada de la superficie del catalizador metálico.

¿Cuáles son los catalizadores usados para el “cracking” del petróleo y cómo funcionan?
El craqueo catalítico es un proceso importante en la industria petrolera, donde el petróleo pasa a través de un lecho de catalizador, lo que hace que las fracciones más pesadas se rompan, produciendo productos más ligeros y valiosos.
El craqueo catalítico de hidrocarburos de alto peso molecular a compuestos más valiosos de menor peso molecular es una aplicación importante de los sólidos ácidos. Los avances en el diseño de reactores, como la introducción de reactores de lecho fluidizado en los que un catalizador está en funcionamiento durante solo unos segundos antes de que se retire, regenere y recircule, han sido de gran importancia.
El catalizador sólido incluye una combinación de zeolita Y ultraestable y cantidades más pequeñas de otras zeolitas, agregadas para adaptar las distribuciones de productos moleculares. Los grandes poros de la zeolita Y permiten el acceso de moléculas de diámetros libres de hasta 7,5 Å a los sitios ácidos.
En el hidrocraqueo de esta fracción, se utilizan catalizadores ácidos cargados con metales de transición en presencia de hidrógeno para dar productos más ligeros mediante craqueo e hidrogenación, lo que permite extraer el máximo valor de cada barril de petróleo.

¿Cuáles son los catalizadores usados para la obtención de amoníaco a partir del nitrógeno atmosférico y cómo funcionan?
El proceso Haber – Bosch es un método que permite la síntesis industrial de amoníaco a gran escala, utilizando como reactivos nitrógeno e hidrógeno en presencia de un catalizador heterogéneo, generalmente a base de Hierro y óxidos de aluminio (AL2O3) y potasio (K2O).
Históricamente el mayor problema vinculado a la síntesis del amoníaco es la dificultad en romper el triple enlace que mantiene unidos los dos átomos de nitrógeno. Por otro lado, la elevada temperatura que sería necesaria para hacer posible tal división, no favorece termodinámicamente a la reacción de síntesis. Sin embargo, como la reacción natural es muy lenta, la presencia de un catalizador de hierro (Fe3+) y óxidos de aluminio (Al2O3) y potasio (K2O) aceleran la reacción, permitiendo así que el equilibrio se alcance con mayor rapidez.
Los factores que aumentan el rendimiento, al desplazar el equilibrio de la reacción hacia los productos (Principio de Le Châtelier), son las condiciones de alta presión (150-300 atmósferas) y altas temperaturas (400-500 °C), resultando en un rendimiento del 10-20%.
Durante la reacción catalítica, las moléculas de hidrógeno y nitrógeno se unen a la superficie del catalizador. Esta reacción debilita los enlaces covalentes de las moléculas y por último ocasiona que las moléculas se disocien. Los átomos de H y N altamente reactivos se combinan para formar moléculas de amoniaco que abandonan la superficie.
El amoniaco, además de ser una materia prima importante, tiene muchas aplicaciones también en la síntesis de otros productos, como por ejemplo el ácido nítrico y fertilizantes. Otros compuestos importantes que se pueden obtener a partir de amoníaco son: sales de amonio, aminas, amidas, hidracinas, cianuros. La lista de aplicaciones del amoníaco es enorme: tintes para textiles, nuevos materiales como el nylon, pinturas, productos de limpieza, extracción minera y fertilizantes.
Este proceso fue desarrollado durante la primera guerra mundial entre los años 1914-1918. Originalmente, el proceso fue patentado por Fritz Haber. Luego, el científico Carl Bosch comercializó de manera exitosa el proceso y aseguró las patentes posteriores. El proceso Haber-Bosch fue utilizado por primera vez a nivel industrial en Alemania, durante la primera guerra mundial. El nitrato de sodio era necesario para construir municiones bélicas, por lo tanto el amoníaco producido se oxidaba para la producción de ácido nítrico y más tarde el ácido producido era utilizado para fabricar diferentes nitrocompuestos explosivos usados en las municiones. Fritz Haber fue galardonado con el Premio Nobel de Química en 1918.

¿Qué es el CO2?
El dióxido de carbono, o CO2, es una molécula muy común de origen natural que contiene dos átomos de oxígeno y un átomo de carbono. En las condiciones cotidianas en la Tierra, el dióxido de carbono es un gas incoloro e inodoro. El CO2 es esencial para la supervivencia de la mayoría de los organismos y ciclos vivos del ecosistema, a través de la respiración todos los seres humanos y animales exhalan dióxido de carbono cuando respiran, y las plantas lo absorben durante un proceso llamado fotosíntesis para crecer.
El dióxido de carbono juega un papel importante en la regulación de la temperatura de la Tierra y es uno de los gases de efecto invernadero. El CO2 tiene un punto de ebullición de 70ºC (sublima), una densidad de 1,53 g/mL y es ligeramente soluble en agua.
El dióxido de carbono se utiliza en la síntesis de urea (fertilizante), para la síntesis orgánica, en la fabricación de hielo seco y aspirina. También se utiliza en refrescos, soldadura, extintores y propelentes de aerosoles. El CO2 se usa a menudo como pesticida para almacenar granos (a una concentración del 60%), estimulante respiratorio, anestésico y agente de eutanasia. Es esencial en un ambiente de cultivo celular in vitro al 5%, donde se disuelve en el medio de cultivo para formar bicarbonato (HCO3-) y actúa como tampón para ayudar a mantener el pH del CO2. Las industrias que utilizan dióxido de carbono incluyen la extinción de incendios; procesamiento, conservación y congelación de alimentos; trabajo de metales; sacrificio de ganado; recuperación de petróleo y gas; y fundiciones. También se utiliza para producir humo o vapores inofensivos en un escenario, enfriar el centro de la pelota de golf antes de enrollarlo y fumigar el arroz.
El dióxido de carbono es un asfixiante, significa que causa toxicidad al desplazar el oxígeno de la atmósfera principalmente en espacios cerrados o en espacios abiertos debido a la liberación repentina de cantidades masivas de CO2 (por ejemplo, con incendios forestales o emisiones naturales durante una erupción volcánica) generando hipoxia.

¿En qué consiste el ciclo del carbono?
El carbono es el segundo elemento más abundante en los organismos vivos. Está presente en todas las moléculas orgánicas, como por ejemplo en las membranas plasmáticas de nuestras células o en las moléculas de azúcar que consumimos a diario. Pero el carbono no es solo una parte importante de nuestro cuerpo, sino que también está presente en forma de combustibles fósiles, en el aire, o disuelto en los océanos.
El ciclo del carbono se puede dividir en dos ciclos interconectados, el ciclo biológico, que comprende el intercambio rápido de carbono entre los organismos vivos; y el ciclo geológico que se encarga del almacenamiento de carbono a largo plazo por medio de procesos geológicos.
Desde hace muchos años, diversas actividades industriales han acelerado el crecimiento tecnológico y económico de países desarrollados y emergentes. Una de estas actividades es el uso de combustibles fósiles (carbón, petróleo y gas natural) para obtener energía. Es por esto que se consideran recursos no renovables, ya que se agotan mucho más rápido de lo que los procesos geológicos pueden producirlos. Cuando estos combustibles fósiles se queman, se libera dióxido de carbono (CO2) en el aire, lo que genera aumento en los niveles de CO2 atmosférico. Alrededor de 21,3 billones de toneladas de CO2 por año son expulsadas al medio ambiente por la quema de combustibles fósiles y se estima que solo la mitad de esa cantidad está siendo absorbida por procesos naturales.
Del mismo modo, la deforestación o la tala de bosques también contribuye a elevar los niveles de CO2. Los árboles mediante fotosíntesis permiten la conversión de CO2 en oxígeno (O2) con ayuda de luz solar. Por ende, cuando se tala un bosque, se eliminan organismos autótrofos (aquellos capaces de producir su propio alimento) y, por lo tanto, buena parte del CO2 en el aire no se convierte en carbono orgánico.
El CO2 es un gas de efecto invernadero, entonces cuando se encuentra en la atmósfera, atrapa el calor y evita que irradie hacia el espacio. Por lo tanto, un aumento en los niveles de CO2 provoca cambios importantes en el clima de la Tierra, lo que es una preocupación ambiental importante en todo el mundo. Por otra parte, el CO2 también puede ser absorbido por el océano, puesto que se disuelve en agua formando carbonato (CO32-) y modificando las condiciones de acidez del mar. Esto dificulta a los organismos marinos a formar y mantener su estructura, por ejemplo, la formación de conchas de moluscos o la estructura de los corales pierden su coloración y la mayoría de las veces mueren.
El carbono existe en el aire como dióxido de carbono (CO2) el cual puede ser disuelto en los océanos al reaccionar con el agua y producir bicarbonato (HCO3-). Los organismos autótrofos, que son aquellos que pueden producir su propio alimento (como las plantas terrestres, algas y bacterias) utilizan la fotosíntesis para poder absorber el CO2 del aire o los iones de bicarbonato del agua y los usan para producir moléculas orgánicas como por ejemplo la glucosa. Luego, los heterótrofos, que se alimentan de otros seres (como lo es el ser humano) consumen estas moléculas orgánicas, obteniendo carbono orgánico. Finalmente, para liberar el carbono orgánico nuevamente a la atmósfera o al océano, los seres vivos utilizan la respiración celular, donde el carbono es liberado en forma de CO2.
La ruta geológica del ciclo del carbono es mucho más lenta que la ruta biológica que acabamos de describir. De hecho, el carbono usualmente tarda millones de años en recorrer la ruta geológica. El almacenamiento de carbono orgánico a largo plazo ocurre cuando la materia proveniente de los organismos vivos es enterrada profundamente bajo la tierra formando combustibles fósiles (petróleo, carbón y gas natural); o cuando se hunde hasta el fondo del océano y forma rocas sedimentarias. La actividad volcánica también es parte de este ciclo, donde por medio del movimiento de las placas tectónicas el carbono puede ser liberado por erupciones volcánicas o respiraderos hidrotermales.

¿Cómo puede la química ayudar a reducir el CO2?
Uno de los grandes retos actuales es la reducción del dióxido de carbono (CO2) en la atmósfera, debido a que es uno de los principales gases de efecto invernadero que contribuyen al cambio climático. Por ello, a lo largo de los años la química se ha convertido en una herramienta esencial para la generación de nuevas tecnologías y productos que contribuyan a la reducción de emisiones de CO2.
A pesar de sus desventajas ambientales, el CO2 es una fuente abundante y económica de átomos de carbono y, debido a esto, se han estudiado opciones atractivas para la utilización y conversión del CO2 en compuestos de valor agregado. Una alternativa es la electrorreducción de CO2 para formar metanol, importante producto de partida de uso industrial. Estos estudios permiten avanzar en la obtención de productos altamente reducidos para su uso como combustibles. Otro ejemplo es el uso de CO2 para transformar epóxidos en carbonatos cíclicos, que tienen amplia aplicación como electrolitos en baterías de ion-litio o como lubricantes industriales. Esta reacción representa una alternativa más ecológica y segura comparada con la ruta convencional de síntesis de carbonatos.
Por otra parte, las tecnologías de secuestro o captura de CO2 también son una alternativa para disminuir las emisiones. Estas tecnologías pueden aplicarse en plantas industriales y centrales eléctricas, y se basan en el uso de procesos y productos químicos que permiten capturar el CO2 de una fuente emisora, comprimirlo, transportarlo e inyectarlo en estructuras geológicas subterráneas para confinarlo.
Otra manera de reducir las emisiones de CO2 es mediante la disminución del uso de combustibles fósiles. Para ello la utilización de energías renovables es esencial. Entre estas se encuentra la biomasa lignocelulósica, que proviene de residuos agrícolas y forestales. El carbono orgánico presente en ella se considera dentro del ciclo biológico del carbono, a diferencia de los combustibles fósiles. Dentro del Núcleo Milenio en Procesos Catalíticos hacia la Química Sustentable, uno de los principales objetivos es la conversión de derivados de la biomasa en moléculas de mayor valor agregado, capaces de ser utilizadas como aditivos de combustibles o biocombustibles.
